[responsivevoice_button voice=”Brazilian Portuguese Female”]
A Agência Nacional de Vigilância Sanitária (Anvisa) liberou, nesta quinta-feira (06), o registro do primeiro produto de terapia gênica no Brasil, indicado para o tratamento de doença rara. Trata-se do Luxturna (voretigene neparvoveque), produzido pela Novartis Biociências. A liberação foi publicada no Diário Oficial da União.
O medicamento é utilizado em crianças acima de 12 meses e em adultos com perda de visão, para o tratamento da distrofia hereditária da retina, causada pela mutação do gene humano RPE65. Entre as distrofias hereditárias da retina estão a amaurose congênita de Leber e a retinose pigmentar.
Segundo a Anvisa, a mutação do gene RPE65 causa a ruptura gradual das células localizadas na parte de trás do olho que formam a retina, causando perda gradual da visão, geralmente na infância ou na adolescência, que progride para cegueira. Até o momento, não havia alternativa terapêutica para a doença.
A agência explica que o produto, elaborado por engenharia genética, é composto por um vírus no qual se inseriu cópia do gene humano RPE65, responsável pela produção de uma enzima necessária para o funcionamento normal da retina. Essa enzima, acrescenta o órgão, permite um melhor funcionamento das células da retina, diminuindo o progresso da doença. O vírus utilizado na fabricação deste produto não causa doença em humanos.
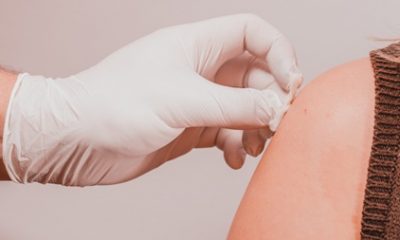
Para a Anvisa, contudo, é importante esclarecer que se trata de um produto de uso hospitalar e sob supervisão médica especializada e administrado via injeção sub-retiniana. Mais “Devem ser adotadas precauções, como a obrigatoriedade de o paciente passar por testes capazes de comprovar que sua perda de visão foi provocada por mutações no gene RPE65, sobre o qual a substância ativa do Luxturna atua, além de outros critérios laboratoriais e clínicos que devem ser avaliados pelo médico”, ressalta, em nota.
Regras muito rígidas para aprovação
A aprovação do medicamento foi possível depois da definição, pela Anvisa, do recente marco regulatório para o registro de produtos de terapia avançada no Brasil, a Resolução da Diretoria Colegiada (RDC) 338/2020. “Essa norma criou um ambiente regulatório seguro para a aprovação de produtos dessa natureza no país”, frisa.
O processo de registro de um produto de terapia avançada, por exemplo, de terapia gênica, envolve a análise da comprovação de segurança por meio de dados robustos de experimentos pré-clínicos, bem como de segurança e eficácia por meio de resultados de estudos clínicos capazes de evidenciar os benefícios ao paciente em determinada dose e posologia terapêutica.
Foram 232 dias úteis até a aprovação do remédio pela Anvisa, considerando desde a submissão dos documentos e os prazos de análise da equipe da Agência até as respostas ao cumprimento das exigências por parte da empresa. Nos Estados Unidos e na Europa, os órgãos reguladores levaram 372 e 331 dias para a aprovação, respectivamente.
Segundo a Anvisa, para a comprovação da eficácia de um medicamento, é necessário a comprovação de produção com requisitos de qualidade e boas práticas de fabricação, de estudos de mecanismos de estabilidade e distribuição do produto.
Cuidados especiais com pacientes pediátricos
Também são exigidos cuidados especiais ao paciente, previsão de eventos adversos possíveis, orientações ao profissional da saúde, definição de monitoramento e gerenciamento de risco pós-uso, além de análises pertinentes para garantir que o remédio e o processo a serem registrados na agência estejam adequados ao uso terapêutico, principalmente nos casos que envolve pacientes pediátricos.
De acordo com a Anvisa, considerando as especificidades dos produtos de terapia gênica e as suas características inovadoras, foi firmado um termo de compromisso com a empresa detentora do registro do medicamento no país a fim de assegurar a realização de estudos complementares com pacientes brasileiros, de forma a acompanhar o perfil de segurança e de eficácia do produto em longo prazo.
Por se tratar de um organismo geneticamente modificado, o medicamento foi avaliado em relação à sua biossegurança pela Comissão Nacional Técnica de Biossegurança (CTNBio), que também se manifestou favorável à sua aprovação.


 Brasil7 anos atrás
Brasil7 anos atrás
 Saúde6 anos atrás
Saúde6 anos atrás
 Destaque6 anos atrás
Destaque6 anos atrás
 Brasil8 anos atrás
Brasil8 anos atrás
 Brasil2 anos atrás
Brasil2 anos atrás
 Sem categoria6 anos atrás
Sem categoria6 anos atrás
 Sem categoria6 anos atrás
Sem categoria6 anos atrás
 Sem categoria5 anos atrás
Sem categoria5 anos atrás